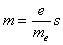1. Ruch stały prostoliniowy.
2. Ruch zmienny.
3. Ruch po okręgu.
4. Zasady dynamiki Newtona.
5. Zasada względności
Galileusza.
6. Siła bezwładności.
7. Rzut poziomy.
8. Pęd, moment pędu, zasada zachowania pędu i zasada
zachowania momentu pędu.
9. Energia i zasada zachowania energii.
10. Praca i moc.
11. Siła tarcia.
12. Moment bezwładności i twierdzenie
Steinera.
13. Zderzenia centralne.
14. Gęstość i ciężar właściwy.
15. Pole grawitacyjne.
16. Prędkości kosmiczne.
17. Elektrostatyka.
18. Atom wodoru według Bohra.
19. Kondensator.
20. Polaryzacja elektryczna.
21. Prąd elektryczny stały.
22. Pole magnetyczne.
23. Prąd zmienny.
24. Drgania.
25. Fale.
26. Optyka geometryczna.
27. Dualizm
korpuskularnofalowy.
28. Fizyka atomowa.
|
18. Atom wodoru według Bohra.
18.1 Atom wodoru według Bohra.
Atom wodoru według Bohra składa się z dodatnio naładowanego jądra
skupiającego prawie całą masę atomu i z elektronu krążącego po orbicie
kołowej.
Aby elektron nie mógł przyjmować dowolnej odległości od jądra,
Bohr wprowadził ograniczenia w postaci postulatów.
18.2 Pierwszy postulat Bohra.
Moment pędu elektronu w atomie wodoru jest wielkością
skwantowaną:
 , ,   . .
Oznaczenia:
b - moment pędu;
V - prędkość elektronu;
r - promień orbity elektronu;
h - stała Plantha
18.3 Warunek kwantyzacji
prędkości.
Prędkość elektronu w atomie wodoru jest wielkością skwantowaną:
 , ,  , ,  , ,  . .
Oznaczenia:
V - prędkość elektronu;
V0 - najmniejsza prędkość elektronu;
h - stała Plantha;
k - stała elektrostatyczna;
e - ładunek elementarny;
18.4 Warunek kwantyzacji
promienia.
Promień orbity w atomie wodoru jest wielkością skwantowaną:
 , ,  , ,  ,
, 
Oznaczenia
r - promień orbity;
r0 - najmniejszy promień orbity;
h - stała Plantha;
V0 - najmniejsza prędkość elektronu
18.5 Warunek kwantyzacji energii.
Energia w atomie jest wielkością skwantowaną:
 , ,  , , 
Energia jest ujemna, aby elektron samodzielnie nie mógł wydostać
się poza atom.
Oznaczenia
E - energia;
E0 - najmniejsza energia atomu;
r0 - najmniejszy promień
orbity;
k -stała elektrostatyczna;
e - ładunek elementarny;
18.6 Następny postulat Bohra.
W stanie stacjonarnym (elektron nie zmienia powłoki) atom nie może
emitować energii.
18.7 Drugi postulat Bohra.
Atom przechodząc z poziomu energetycznego wyższego na niższy
oddaje nadmiar energii w postaci kwantu promieniowania
elektromagnetycznego.
Częstotliwość wyemitowanej energii :
 , , 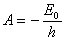
poziom energetyczny - stan o ściśle określonej energii.
poziom podstawowy - wszystkie elektrony znajdują się najbliżej jądra.
Oznaczenia:
n - częstotliwość;
l - poziom, na który spada atom;
n - poziom
początkowy.
18.8 Moment magnetyczny atomu i
elektronu.
Moment magnetyczny jest zawsze przeciwnie skierowany do momentu pędu.
Moment magnetyczny :
 ; ;
 ,
,  . .
Moment magnetyczny w atomie wodoru jest wielkością skwantowaną.
Oznaczenia:
b - moment pędu;
h - stała Plantha;
e - ładunek elementarny;
me - masa
elektronu;
n - numer orbity;
m - moment magnetyczny;
m - moment
magnetyczny Bohra (wielkość stała)
18.9 Spinowy moment magnetyczny.
Jest związany z ruchem elektronu wokół własnej osi.
 ; ; 
spinowy moment magnetyczny:
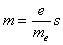
Spinowy moment magnetyczny jest odpowiedzialny za właściwości
magnetyczne materii (zob.pkt. 22.11)
Oznaczenia:
h - stała Plantha;
e - ładunek elementarny;
me - masa elektronu;
m
-spinowy moment magnetyczny;
s - spin
|
|
|



 ,
, 
 .
. ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 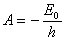
 ;
;  ;
;